Libreta de apuntes
Enlaces relacionados
- Aceto balsámico
- Ácido acético
- Ácido ascórbico
- Ácido bórico
- Ácido butírico
- Ácido cafeico
- Ácido cítrico
- Ácido etanoico
- Ácido fólico
- Ácido fórmico
- Ácido fosfórico
- Ácido láctico
- Ácido málico
- Ácido metanoico
- Ácido propanoico
- Ácido sórbico
- Ácido tartárico
- Ácidos orgánicos
- Aditivos alimentarios
- Alcohol
- Alcohol etílico
- Bacterias lácticas
- Conservas caseras
- Cerveza
- Etanol
- Etileno
- Fermentación
- Fermentación acética
- Fermentación alcohólica
- Fermentación butírica
- Fermentación láctica
- Fermentación maloláctica
- Levadura
- Levadura química
- Metanol
- Recetas de cocina
- Sidra
- TASA DE ALCOHOLEMIA
- Vinagre
- Vino
- XILITOL
¿Qué es el etanol?
| General | |
| Nomenclatura IUPAC | n/d |
| Fórmula semidesarrollada | CH3-CH2-OH |
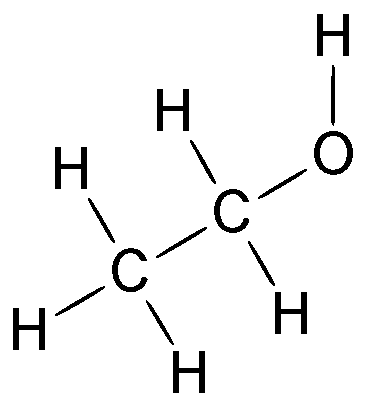
| Fórmula estructural: | Ver imagen |
| Fórmula molecular | C2H5OH |
| Número CAS | 64-17-5 |
| Propiedades físicas | |
| Estado de agregación | Líquido |
| Apariencia | Incoloro |
| Densidad | 810 kg/m3 |
| Masa molecular | 46,07 uma |
| Punto de fusión | 158,9 K (-114,1 °C) |
| Punto de ebullición | 351,6 K (78,6 °C) |
| Temperatura crítica | 514 K (241 °C) |
| Presión crítica | 63 atm. |
| Viscosidad | 1.074 mPa·s a 20 °C. |
| Propiedades químicas | |
| Acidez | (pKa) 15,9 |
| Solubilidad en agua | Miscible |
| KPS | n/d |
| Momento dipolar: | n/d D |
| Termoquímica | |
| ΔfH0gas | -235.3 kJ/mol |
| ΔfH0líquido | -277.6 kJ/mol |
| Valores en el SI y en condiciones normales (0 °C y 1 atm), salvo que se indique lo contrario. | |
El alcohol etílico o etanol es un alcohol que se presenta como un líquido incoloro e inflamable con un punto de ebullición de 78 °C. Al mezclarse con agua en cualquier proporción, da una mezcla azeotrópica. Es un líquido transparente e incoloro, con sabor a quemado y un olor agradable característico
Su fórmula química es H3C-CH2-OH , principal producto de las bebidas alcohólicas.
Es el alcohol que se encuentra en bebidas como la cerveza, la sidra, el vino y el brandy. Debido a su bajo punto de congelación, ha sido empleado como fluido en termómetros para medir temperaturas inferiores al punto de congelación del mercurio, -40 °C, y como anticongelante en radiadores de automóviles.
Normalmente el etanol se concentra por destilación de disoluciones diluidas. El de uso comercial contiene un 95% en volumen de etanol y un 5% de agua. Ciertos agentes deshidratantes extraen el agua residual y producen etanol absoluto. El etanol tiene un punto de fusión de -114,1°C, un punto de ebullición de 78,5°C y una densidad relativa de 0,789 a 20°C.
Desde la antigüedad, el etanol se ha obtenido por fermentación de azúcares. Todas las bebidas con etanol y casi la mitad del etanol industrial aún se fabrican mediante este proceso. El almidón de la patata, del maíz y de otros cereales constituye una excelente materia prima. La enzima de la levadura, la cimasa, transforma el azúcar simple en dióxido de carbono. La reacción de la fermentación queda, representada en la ecuación:
C6H12O6 --> 2C2 H5OH + 2CO2
Esta reacción es realmente compleja, ya que los cultivos impuros de levaduras producen una amplia gama de otras sustancias, como el aceite de fusel, la glicerina y diversos ácidos orgánicos. El líquido fermentado, que contiene de un 7 a un 12% de etanol, se concentra hasta llegar a un 95% mediante una serie de destilaciones. En la elaboración de ciertas bebidas como el whisky y el brandy, algunas de sus impurezas son las encargadas de darle su característico sabor final. La mayoría del etanol no destinado al consumo humano se prepara sintéticamente, tanto a partir del etanal (acetaldehído) procedente del etino (acetileno), como del eteno del petróleo. También se elabora en pequeñas cantidades a partir de la pulpa de madera.
La oxidación del etanol produce etanal que a su vez se oxida a ácido etanoico. Al deshidratarse, el etanol forma dietiléter. El butadieno, utilizado en la fabricación de caucho sintético, y el cloroetano, un anestésico local, son otros de los numerosos productos químicos que se obtienen del etanol. Este alcohol es miscible (mezclable) con agua y con la mayor parte de los disolventes orgánicos. Es un disolvente eficaz de un gran número de sustancias, y se utiliza en la elaboración de perfumes, lacas, celuloides y explosivos. Las disoluciones alcohólicas de sustancias no volátiles se denominan tinturas. Si la disolución es volátil recibe el nombre de espíritu.
Obtención
Para obtener etanol libre de agua se aplica la destilación azeotrópica en una mezcla con benceno o ciclohexano. De estas mezclas se destila a temperaturas más bajas el azeótropo, formado por el disolvente auxiliar con el agua, mientras que el etanol se queda retenido. Otro método de purificación muy utilizado actualmente es la absorción física mediante tamices moleculares A escala de laboratorio también se pueden utilizar disecantes como el magnesio, que reacciona con el agua formando hidrógeno y óxido de magnesio.
Formas de adulteración
El contenido de alcohol etílico en una bebida que no se halla sometido a controles de calidad y sanidad, puede estar diluido o rebajado con metanol, un alcohol derivado de la madera que al metabolizarse ocasiona ceguera permanente. Ejemplo de ello es la bebida alcohólica ilegal conocida como Pájaro verde, que es preparada en el ambiente carcelario.
Usos
Además de usarse con fines culinarios, el etanol se utiliza ampliamente en muchos sectores industriales y en el sector farmacéutico, como principio activo de algunos medicamentos y cosméticos (es el caso de el alcohol antiséptico 70º GL y en la elaboración de ambientadores y perfumes). Es un buen disolvente, puede utilizarse como anticongelante.
Se emplea como combustible industrial y doméstico. En el uso doméstico, se emplea el alcohol de quemar. Éste además contiene compuestos como la piridina o el metanol u otras sustancias denominadas desnaturalizantes, que impiden su uso como alimento, ya que el alcohol para consumo suele llevar impuestos especiales. En algunos países, en vez de etanol se utiliza metanol como alcohol de quemar.
En Brasil se añade etanol a la gasolina para bajar la importación de petróleo, dando lugar a la alconafta. Este país es uno de los principales productores (con 18 mil millones de litros anuales), con esto reducen un 40 % de sus importaciones de crudo. Esta última aplicación se extiende también cada vez más en otros países para cumplir con el protocolo de Kyoto. Estudios del Departamento de Energía de USA dicen que el uso en automóviles reduce la producción de gases de invernadero en un 85%. En países como México existe la política del Gobierno federal de apoyar los proyectos para la producción integral de etanol y reducir la importación de gasolinas que ya alcanza el 60 %.
La industria química lo utiliza como compuesto de partida en la síntesis de diversos productos, como el acetato de etilo (un disolvente para pegamentos, pinturas, etc.), el éter dietílico, etc. También se aprovechan sus propiedades desinfectantes.
También es un desinfectante. Su mayor potencial bactericida se obtiene a una concentración de aproximadamente el 70 %.
Toxicología
El etanol puede afectar al sistema nervioso central, provocando estados de euforia, desinhibición, mareos, somnolencia, confusión , alucinaciones (como lo sean ver doble o que todo se mueve de forma espontánea). Al mismo tiempo, baja los reflejos. Con concentraciones más altas ralentiza los movimientos, impide la coordinación correcta de los miembros, pérdida temporal de la visión, etc. En ciertos casos se produce un incremento en la irritabilidad del sujeto intoxicado como también en la agresividad; en otra cierta cantidad de individuos se ve afectada la zona que controla los impulsos, volviéndose impulsivamente descontrolados y frenéticos. Finalmente, conduce al coma y puede provocar la muerte.
La resistencia al alcohol parece aumentar en las personas adultas, de mayor peso y de menor altura, mientras que los niños son especialmente vulnerables. Se han comunicado casos de bebés que murieron por intoxicación debida a la inhalación de vapores de etanol tras haberles aplicado trapos impregnados de alcohol. La ingesta en niños puede conducir a un retardo mental agravado o a un subdesarrollo físico y mental. También se han realizado estudios que demuestran que si las madres ingerían alcohol durante el embarazo, sus hijos podían ser más propensos a tener malformaciones o retardos.
Analítica
Un método de determinación de la concentración aproximada de etanol en la sangre aprovecha el hecho de que en los pulmones se forma un equilibrio que relaciona esta concentración con la concentración de vapor de etanol en el aire expirado. Este aire se hace pasar por un tubo donde se halla gel de silicio impregnado con una mezcla de dicromato y de ácido sulfúrico. El dicromato, de color rojo anaranjado, oxida el etanol a acetaldehído y es reducido, a su vez, a cromo (III), de color verde. La longitud de la zona que ha cambiado de color indica la cantidad de etanol presente en el aire si se hace pasar un determinado volumen por el tubo.
Documentación
http://es.encarta.msn.com
http://es.wikipedia.org/