Libreta de apuntes
Enlaces relacionados
- Ácidos orgánicos
- Ácidos grasos
- Albúmina
- Aminoácidos
- Aminoácidos esenciales
- Antioxidantes
- Biotina
- Carnitina
- Caseína
- Clara de huevo
- Colágeno
- Colesterol
- DOPAMINA
- Endorfinas
- Feniletilamina
- FIBRA DIETÉTICA
- Gelatina
- Glúcidos
- Glucósidos
- Glutatión
- Gluten
- Hipercolesterolemia
- Lípidos
- Aditivos alimentarios
- Lipoproteínas
- Oligoelementos
- Ovoalbúmina
- Proteínas
- Quimilicrones
- Radicales libres
- Triptófano
ÍNDICE
La página de Bedri
¿Qué es el colágeno?
El colágeno es una molécula proteica que forma fibras, las fibras colágenas. Estas se encuentran en todos los organismos pluricelulares. Son secretadas por las células del tejido conjuntivo como los fibroblastos, así como por otros tipos celulares. Es el componente más abundante de la piel y de los huesos, cubriendo un 25% de la masa total de proteínas en los mamíferos.
El colágeno es una proteína fibrosa que forma el tejido conectivo, y que en los mamíferos y aves constituye una proporción muy importante de las proteínas totales, del orden de un cuarto del total, lo que la hace la mayoritaria.
Las fibras colágenas son flexibles, pero ofrecen gran resistencia a la tracción. El punto de ruptura de las fibras colágenas de los tendones humanos se alcanza con una fuerza de varios cientos de kilogramos por centímetro cuadrado. A esta tensión solamente se han alargado un pequeño porcentaje de su longitud original.
Cuando el colágeno se desnaturaliza por ebullición y se deja enfriar, manteniéndolo en una solución acuosa, se convierte en una sustancia bien conocida, la gelatina.
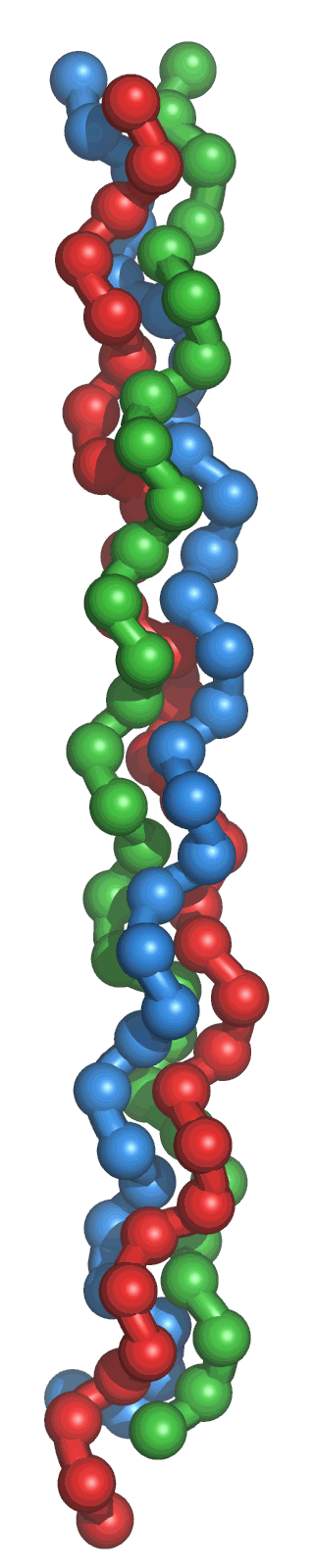
Las peculiaridades de la secuencia del colágeno hacen posible su peculiar estructura secundaria. El pequeño tamaño de la glicina permite que se entrecrucen tres cadenas, mientras que la rigidez que produce el anillo de prolina favorece el ángulo de giro que adoptan.
Al aumentar la edad del animal, el colágeno presenta mayor número de entrecruzamientos por uniones covalentes entre las cadenas. Estos puentes se forman por la acción inicial del enzima lisinoxidasa, que transforma en aldehidos a la lisina o a la hidroxilisina, aldehidos que posteriormente se pueden condensar mediante reacciones químicas espontáneas con otros grupos.
El calentamiento del colágeno produce su desnaturalización, cuya primera consecuencia es un enorme acortamiento de las fibras, acortamiento que se produce a una temperatura característica para el colágeno de cada especie animal. También se destruye la estructura de triple hélice La temperatura a la que se desnaturaliza el colágeno depende del contenido de prolina e hidroxiprolina: A mayor contenido, mayor es la temperatura necesaria. En este sentido, existe una gran diferencia en contenido de prolina y en la temperatura de desnaturalización entre el colágeno de los animales de sangre caliente y el de los peces, ambas bastante mas pequeñas en los segundos. En algunos peces de aguas frías, el colágeno se desnaturaliza a menos de 20ºC. En el cocinado de los alimentos, parte del colágeno se solubiliza y forma la "gelatina", que imparte viscosidad a los guisos.
El colágeno es un componente abundante en piel, tendones, sistema vascular y otros materiales de desecho, de donde se puede obtener la gelatina comercial, que es un producto de degradación parcial del colágeno, extraída por calentamiento tras un tratamiento en medio ácido o alcalino. Dependiendo del tipo de tratamiento, se obtiene un tipo de gelatina distinto . La gelatina es un material muy útil en tecnología de los alimentos, para la obtención de geles reversibles térmicamente, de punto de "fusión" muy bajo. Estos geles se forman por enfriamiento mediante la unión de cadenas por reconstrucción parcial de hélices del tipo de las del colágeno, pero con grandes zonas desorganizadas.
Desde el punto de vista nutricional, el colágeno y aún más la gelatina, son proteínas muy desequilibradas en cuanto a su composición de aminoácidos. El colágeno es muy deficiente en triptófano, y la gelatina prácticamente carece de él, ya que el poco que existía se suele destruir en su preparación. La facilidad con la que se proteoliza depende mucho de su estado. El colágeno nativo es bastante resistente a la proteoliis por parte de la mayoría de las proteinasas, mientras que el colágeno desnaturalizado se hidroliza fácilmente
Síntesis del colágeno
El colágeno se origina por una proteína precursora (monómero) llamada tropocolágeno que mide alrededor de 300 nanómetros de largo y 1,4 nm de diámetro. El tropocolágeno está formado por tres cadenas polipeptídicas llamadas cadenas alfa (no hélices alfa). Cada cadena α esta constituida por un polipéptido, formado por una repetición en tándem de tres aminoácidos siendo muy ricas en prolina o hidroxiprolina y glicina, las cuales son fundamentales en la formación de la superhélice. Cada cadena tiene un peso molecular de alrededor de 100.000 daltons.
Gracias a su estructura anular rígida, la prolina estabiliza la conformación helicoidal en cada una de sus cadenas α; La glicina, sin embargo, se sitúa ocupando un lugar cada tres residuos localizándose a lo largo de la región central, debido sin duda a su pequeño tamaño, y favoreciendo al denso empaquetamiento de las tres cadenas α, de configuración levógira, necesario para la formación de la superhélice de colágeno. Las tres cadenas se enrollan y se fijan mediante enlaces transversales para formar una triple hélice dextrógira con una distancia entre las vueltas de 8,6 nanómetros.
La triple hélice se mantiene unida entre si debido a puentes de hidrógeno, que no afectan a todas las tres cadenas, sino aproximadamente a 2/3 de cada cadena alfa. Además, los tropocolágenos se unen entre si por medio de enlaces entre algunos aminoácidos, llamados "crosslinkings". Ademas poseen unos pocos aminoacidos llamados lisinas, las cuales sufren transformaciones catalizadas por la enzima lisina oxidasa, la cual actua sobre los residuos N, transformandolos en grupos aldehidos, por lo que la lisina pasa a llamarse alisina, que es capaz de formar uniones covalentes con otras alisinas para consolidar las fibrillas de colageno.
Formación del colágeno
Cada una de las cadenas polipeptídicas es sintetizada por los ribosomas unidos a la membrana del retículo endoplásmico y luego son traslocadas al lumen del mismo en forma de grandes precursores (procadenas α), presentando aminoácidos adicionales en los extremos amino y carboxilo terminales. En el retículo endoplásmico los residuos de prolina y lisina son hidroxilados para luego algunos ser glucosilados en el aparato de Golgi, parece ser que estas hidroxilaciones son útiles para la formación de puentes de hidrógeno intercatenarios que ayudan a la estabilidad de la superhélice.
Tras su secreción, los propéptidos de las moléculas de procolágeno son degradados mediante proteasas convirtiéndolas en moléculas de tropocolágeno asociándose en el espacio extracelular formando las fibrillas de colágeno.
La formación de fibrillas está dirigida, en parte, por la tendencia de las moléculas de procolágeno a autoensamblarse mediante enlaces covalentes entre los residuos de lisina, formando un empaquetamiento escalonado y periódico de las moléculas de colágeno individuales en la fibrilla.
Función
Las fibras de colágeno forman estructuras que resisten las fuerzas de tracción. Su diámetro en los diferentes tejidos es muy variable y su organización también; en la piel de los mamíferos están organizadas como cestos de mimbre, lo que permite la oposición a las tracciones ejercidas desde múltiples direcciones. En los tendones lo están en haces paralelos que se alinean a lo largo del eje principal de tracción. En el tejido óseo adulto y en la córnea se disponen en láminas delgadas y superpuestas paralelas una a otra pero formando un ángulo recto con las capas adyacentes.
Las células interactúan con la matriz extracelular tanto mecánica como químicamente, lo que produce notables efectos sobre la arquitectura tisular. Así, distintas fuerzas actúan sobre las fibrillas de colágeno que se han secretado, ejerciendo tracciones y desplazamientos sobre ellas, lo que provoca su compactación y su estiramiento.
Tipos de colágeno
Existen varios tipos de colágeno, designados por números romanos. En el colageno de tipo I, el más abundante, la unidad estructural constituyente es el tropocolágeno, una proteína de alrededor de 300.000 de peso molecular, constituida por tres cadenas del mismo tamaño, dos de ellas idénticas, las llamadas a1, y otra ligeramente distinta, la a2. Las tres cadenas están unidas entre sí por puentes de hidrógeno entre los grupos amino y carboxilo de los restos de glicina, y por puentes de hidrógeno con las cadenas laterales de la hidroxiprolina, formando una hélice triple, estructura peculiar del colágeno. Esta hélice solamente se rompe en los extremos.
El colágeno de tipo III está formado por tres cadenas idénticas a1, y tiene la peculiaridad de que en el extremo carboxilo terminal las tres cadenas no están agrupadas en forma de hélice, sino unidas entre ellas por puentes disulfuro. Este tipo de colágeno, situado en en el perimio y endomisio del músculo, parece ser especialmente importante en cuanto a conferir dureza a la carne.
Las unidades de tropocolágeno, que tienen una longitud de unos 2.800 amstrongs, se encuentran agrupadas de forma paralela, unidas unas a otras para formar las fibras de colágeno. Dentro de las fibras, las unidades están desplazadas aproximadamente un cuarto de su longitud con respecto a las contiguas, y cada unidad dista de la siguiente unos 400 amstrongs
El colágeno en lugar de ser una proteína única, se considera una familia de moléculas estrechamente relacionadas pero genéticamente distintas. Se describen varios tipos de colágeno:
-
Colágeno tipo I: Se encuentra
abundantemente en la dermis, el hueso, el tendón y la córnea. Se
presenta en fibrillas estriadas de 20 a 100 nm de diámetro, agrupándose
para formar fibras colágenas mayores. Sus subunidades mayores están
constituidas por cadenas alfa de dos tipos, que difieren ligeramente en
su composición de
aminoácidos y en su secuencia. A uno de los cuales se
designa como cadena alfa1 y al otro, cadena alfa2. Es sintetizado por
fibroblastos, condroblastos y osteoblastos. Su función principal es la
de resistencia al estiramiento.
Se caracteriza porque la molécula de tropocolágeno en este caso está constituida por dos cadenas que se denominan alfa 1, o sea, dos cadenas alfa 1 idénticas y una segunda cadena que se denomina alfa 2, que tiene una secuencia de aminoácidos distinta.
Este es un colágeno fabricado fundamentalmente por los fibroblastos. Predomina en el hueso, en los cartílagos y en la dermis, o sea, que la mayor parte de colágeno de la dermis, que es lo que nos interesa a nosotros, pertenece a este tipo I de colágeno.
Son las fibras más gruesas de todas, fuertemente birrefringentes al microscopio de polarización y se tiñen selectivamente con un colorante específico que se denomina picrosirius. Este colorante permite distinguir el colágeno I del II del III y también del IV y el V. En este caso las fibras aparecen de un color amarillo rojizo. Estas fibras tienen el bandeado transversal, sea la periodicidad transversal bien desarrollada, bien característica y constituye el colágeno más importante desde el punto de vista estructural.
-
Colágeno tipo II: Se encuentra sobre
todo en el cartílago, pero también se presenta en la córnea embrionaria
y en la notocorda, en el núcleo pulposo y en el humor vítreo del ojo. En
el cartílago forma fibrillas finas de 10 a 20 nanómetros, pero en otros
microambientes puede formar fibrillas más grandes, indistinguibles
morfológicamente del colágeno tipo I. Están constituidas por tres
cadenas alfa2 de un único tipo. Es sintetizado por el condroblasto.
Su función principal es la resistencia a la presión intermitente.Aparece en el cartílago y otras estructuras, como por ejemplo el liquido que rellena el globo ocular llamado humor vítreo. Son fibras, por el contrario, muy finas, que no se ven o se ven con dificultad en el microscopio óptico, pero sí se ven con el microcopio electrónico.
Son fibras que no presentan este bandeado característico que presenta las fibrillas del tipo I y están constituidas por tres cadenas donominadas alfa 1. Son tres cadenas iguales, entrelazadas, donde lo característico es que hay más, hidroxilisina y lisina que en el colágeno ordinario de tipo I.
-
Colágeno tipo III: Abunda en el
tejido conjuntivo laxo, en las paredes de los vasos sanguíneos, la
dermis de la piel y el estroma de varias glándulas. Parece un
constituyente importante de las fibras de 50 nanómetros que se han
llamado tradicionalmente fibras reticulares. Está constituido por una
clase única de cadena alfa3. Es sintetizado por las células del músculo
liso, fibroblastos, glía. Su función es la de sostén de los órganos
expandibles.
Corresponde a lo que clásicamente se denominaba a las fibrillas de reticulina, que aparecían impregnadas de color negro con las sales de plata. Es un colágeno que aparece con mucha frecuencia vinculado al músculo liso y es fundamentalmente el colágeno de las vísceras, aunque también está presente en mayores cantidades en la dermis, sobre todo alrededor de los nervios y los vasos sanguíneos que vimos que constituían parte de esa estructura.
Desde el punto de vista de la composición de los polipéptidos tiene tres cadenas denominadas alfa 1. O sea, tiene tres cadenas iguales, con una disposición de aminoácidos propia, donde predomina la hidroxiprolina y donde además aparece un aminoácido que no es muy común en otros colágenos, que es la cistina.
-
Colágeno tipo IV: Es el colágeno que
forma la lámina basal que subyace a los epitelios. Es un colágeno que no
se polimeriza en fibrillas, sino que forma un fieltro de moléculas
orientadas al azar, asociadas a proteoglicanos y con las
proteínas
estructurales laminina y fibronectina. Es sintetizado por las células
epiteliales y endoteliales. Su función principal es la de sostén y
filtración.
Aparecen específicamente localizados en las membranas basales, o sea, en aquellas estructuras que separan generalmente los epitelios de los tejidos conjuntivos. El colágeno IV es muy frecuente en todas las membranas basales.
- Colágeno tipo V: Presente en la mayoría del tejido intersticial. Se asocia con el tipo I. El colágeno V se ha descrito específicamente en la membrana basal de la placenta, que citamos solo para dar un ejemplo de cómo esta proteína se adapta a distintas funciones biológicas que van apareciendo a lo largo do la evolución de las especies.
- Colágeno tipo VI: Presente en la mayoría del tejido intersticial. Sirve de anclaje de las células en su entorno. Se asocia con el tipo I.
- Colágeno tipo VII: Se encuentra en la lámina basal.
- Colágeno tipo VIII: Presente en algunas células endoteliales.
- Colágeno tipo IX: Se encuentra en el cartílago articular maduro. Interactúa con el tipo II.
- Colágeno tipo X: Presente en cartílago hipertrófico y mineralizado.
- Colágeno tipo XI: Se encuentra en el cartílago. Interactúa con los tipos II y IX.
- Colágeno tipo XII: Presente en tejidos sometidos a altas tensiones, como los tendones y ligamentos. Interactúa con los tipos I y III.
- Colágeno tipo XIII: Es ampliamente encontrado como una proteína asociada a la membrana celular. Interactúa con los tipos I y III.
La composición de aminoácidos del colágeno es bastante particular. La glicina representa, en moles, proximadamente 1/3 de los aminoácidos presentes. También contienen cantidades muy elevadas de prolina, y de hidroxiprolina (hasta el 10%), y es una de las pocas proteínas que contiene hidroxilisina. La presencia de hidroxiprolina suele utilizarse como criterio analítico para evaluar la cantidad de colágeno (tejido conectivo) presente en productos cárnicos picados.
Tanto la hidroxilisina como la hidroxiprolina se producen después de la síntesis de la cadena polipeptidica, por modificación de los aminoácidos no hidroxilados por enzimas específicos.
La secuencia primaria de las cadenas del colágeno es también muy peculiar, ya, excepto en los extremos de la cadena, la glicina está distribuida de forma regular, ocupando la posición de uno de cada tres aminoácidos.
Documentación
http://www.cueronet.com
http://milksci.unizar.es
http://es.wikipedia.org/